近段时间,国内医疗器械领域可谓是利好频出。随着国产医疗器械技术不断突破、多项支持政策的落地,“推进健康中国建设,把保障人民健康放在优先发展的战略位置,完善人民健康促进政策”,使医疗器械行业持续增长和扩容,迎来新一轮的爆发增长。
医疗器械临床试验是一个多学科协作、系统性的工作和过程。CRO企业作为专业技术机构,能在短时间内组织起一个具有高度专业化和丰富临床经验的队伍,在节约成本、提高效率等方面具有强大的优势,受到不少医疗器械企业的信任和青睐。

北京水木菁创医药科技有限公司(以下简称“水木菁创”)是一家专注于为医疗器械企业提供专业临床研究技术服务的合同研究组织(CRO),主要为医疗器械(含体外诊断试剂)企业提供医疗器械临床试验、医学撰写、全球注册、GMP体系辅导等专业化技术服务与一站式解决方案。公司深耕医疗器械临床试验服务,以高瞻远瞩的目光,丰富的实践经验,不断推进临床试验发展,持续深化全国布局。公司总部设于北京,占据信息交流互通优势;结合全国医疗器械企业和临床试验机构分布特点及架构,分别在广州、南京、成都均设立分公司,并在杭州、天津、长沙、沈阳、郑州、武汉、西安、合肥等国内13个城市安排了驻地人员,更高效、精准、规范地服务于每一个医疗器械企业,切实、根本保障每一个项目的质量,更有力应对突发事件、更有效推进项目进度。与全国超过200多家临床研究中心建立合作关系,形成覆盖全国的完善服务网络,合理地进行资源利用和整合,包括在疫情常态化的大环境下,可较大程度地减少外部环境变化对于临床试验的影响。

蓄积深厚,全方位一体化服务
医疗器械技术演进的连续性,决定了临床试验项目数据积累的重要性。依托中关村水木医疗科技集团下设的北京中关村水木医疗科技有限公司、北京水木菁创医药科技有限公司、北京水木济衡生物技术有限公司以及成都水木医疗科技有限公司形成了集“工程化研发+检验检测+体系建立运行辅导、临床试验+注册”于一体的全产业链一站式服务平台,解决了创新医疗器械企业产业化“最后一公里”的难题。经过多年深耕沉淀,水木菁创在临床试验方面有了扎实的技术积累,凭借着敏锐的洞察力和市场可预见性,通过多部门交叉沟通,协调配合,多线并行,让临床试验周期更短,成本更低,产品取证更快!
目前水木菁创正在运行的百余个项目中,临床试验与注册项目占71%,以创新、国产三类医疗器械产品为主,涵盖有源、无源、IVD。在今年1月份,水木菁创协助申办方斩获了中国首张国产膝关节置换手术机器人注册证,实现此领域的国产“零的突破”。另外,水木菁创承接的国内首台髋膝关节置换机器人产品也顺利获批,在短短两年内,水木菁创十余项手术机器人项目陆续获批、结题、收尾,有条不紊向前推进,并且总结出一套专门适用于此类项目的管理经验和执行规划。值得一提的是,凭借着专业资源背景、大数据,对手术机器人项目市场和法规的专业解读,结合全方位一体化服务,水木菁创积极涉及康复科、骨科、泌尿外科等多领域,覆盖方向包括康复机器人、骨科手术导航定位系统、膝关节手术导航系统、髋关节假体系统、手术机器人定位系统、采血机器人、手术机器人麻醉机/无创呼吸机多款手术机器人、腹腔手术机器人等,在国产手术机器人赛道上不断迈进!

在体外诊断临床试验方面,公司在专业人才、业务经验、技术体系、质量控制等方面更是硕果累累。在2020年初,水木菁创率先完成了2个新型冠状病毒(2019-nCoV)抗体检测试剂盒的应急批件申请(分别是量子点荧光免疫层析法和酶联免疫法),为抗疫贡献水木菁创的一份力量;2021年,水木菁创IVD事业部,卓越完成2021年销售及回款指标;在2022年,目前有8个新型冠状病毒(2019-nCoV)抗体检测试剂盒的临床项目在进行中。
厚积薄发,砥砺前行。水木菁创不断积累深厚实践经验,为医疗器械企业提供优质、高效、便捷、精准的一站式产品上市解决方案,并致力于为中国医疗器械研、检、产、商提供专业支持,使医疗企业省心、放心。
数据化系统,高效的管理流程
随着我国医疗器械行业的快速发展,国家不断鼓励创新、鼓励自主研发,新产品不断涌现,医疗器械法规也在每年更新、加大监管力度,无形中提高了医疗器械准入门槛,让更多有科技内涵、更懂器械规范、更具有临床价值的新鲜血液加入,形成良性循环。临床试验机构所承接的医疗器械临床试验项目逐渐丰富。临床试验是评价医疗器械产品有效性和安全性的重要手段,其实施过程的规范性和科学性直接影响到临床数据的准确性和可靠性,同时也是产品能否成功获得药监部门批准、进入临床使用的必要条件。因此,医疗器械临床试验每一步都不容有失误,规范性地收集、整理、分析和总结医疗器械临床试验数据有助于提高临床试验管理质量,同时有利于监管机构快速、高效地掌握临床试验的开展情况,提高评审效率。
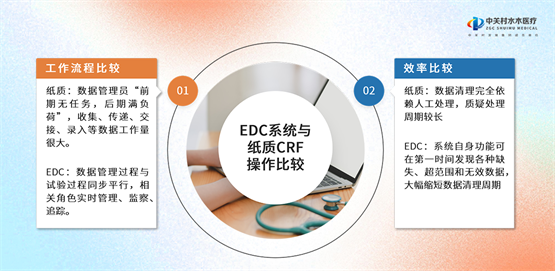
面对临床试验数据采集和传输追踪的耗时难题,及时、准确、完整的临床试验数据收集和科学合理的数据管理,不仅能提高临床试验的质量,还能缩短研究周期。水木菁创采用先进的EDC系统,完成临床试验电子数据采集及数据管理,使数据管理和试验过程同步运行,相关岗位人员可以随时管理、监察和追踪,科学管理、真实记录。
在传统模式中,临床试验主要依靠纸质的病例报告表(CRF)完成数据的采集和管理。医疗器械临床试验项目需要高度的严谨性和正确性,纸质数据一旦发现有疑虑,只能通过人工手动反复检查、验证。漫长的处理周期,使项目难以推进。但在EDC系统支持下,系统能在第一时间发现各种缺失、超范围的无效数据。系统的数据管理,能够大幅缩减数据清理周期,提高团队工作效率。同时,EDC系统通过及时采集、掌握不良事件,尽早采取相应措施保护受试者的权益,与原有的纸质CRF严格区分开来,使临床试验数据真实可溯源,达到数据集中化管理的目的。

水木菁创在平台高效整合模式及EDC系统、ETMS系统、OA系统等加持下,加快了项目转化时间。如在华北区某项目,一般情况下从样品送检到临床试验的首例入组需要16.5-32.5个月,通过水木菁创的平台进行整合优化,提供一站式、全过程解决方案,耗时只需8.5-12.5个月,对比传统流程,首例入组前耗时缩短了60%以上。项目周期缩短,投入资金减少,极大地为企业降低了成本。使企业项目能更快地完成临床试验,加快产品上市步伐,实现盈利。
医疗器械是长坡厚雪的优质赛道,在政策预期改善、自主可控逻辑强化、诊疗需求持续提升等催化下,使得不少企业纷纷加入其中。在此时,选择颇有经验的临床试验CRO企业合作,能有效地提高临床试验项目的效率,一定程度上降低项目的风险。水木菁创多年的实践经验积累,获得中关村国家自主创新示范区高精尖产业创新平台、软件著作权登记证书、ISO 9001:2015质量管理体系认证等荣誉,是医疗器械临床试验服务领域一匹强大黑马,实力获得业内人士的高度关注和认可。
未来,水木菁创也将继续助推医疗器械临床试验发展,助力申办企业加快创新产品上市步伐,为国产化医疗器械落地贡献一份力量。
如想了解更多相关内容,可以搜索并关注“水木菁创医药技术服务”微信公众号。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
文章投诉热线:156 0057 2229 投诉邮箱:29132 36@qq.com





