盐酸胺碘酮注射液获美国FDA上市许可
普利制药于近日收到美国食品药品监督管理局(FDA)签发的盐酸胺碘酮注射液的上市许可。这是普利制药今年收到的第13张美国ANDA。

标志着普利制药具备在美国销售盐酸胺碘酮注射液的资格。

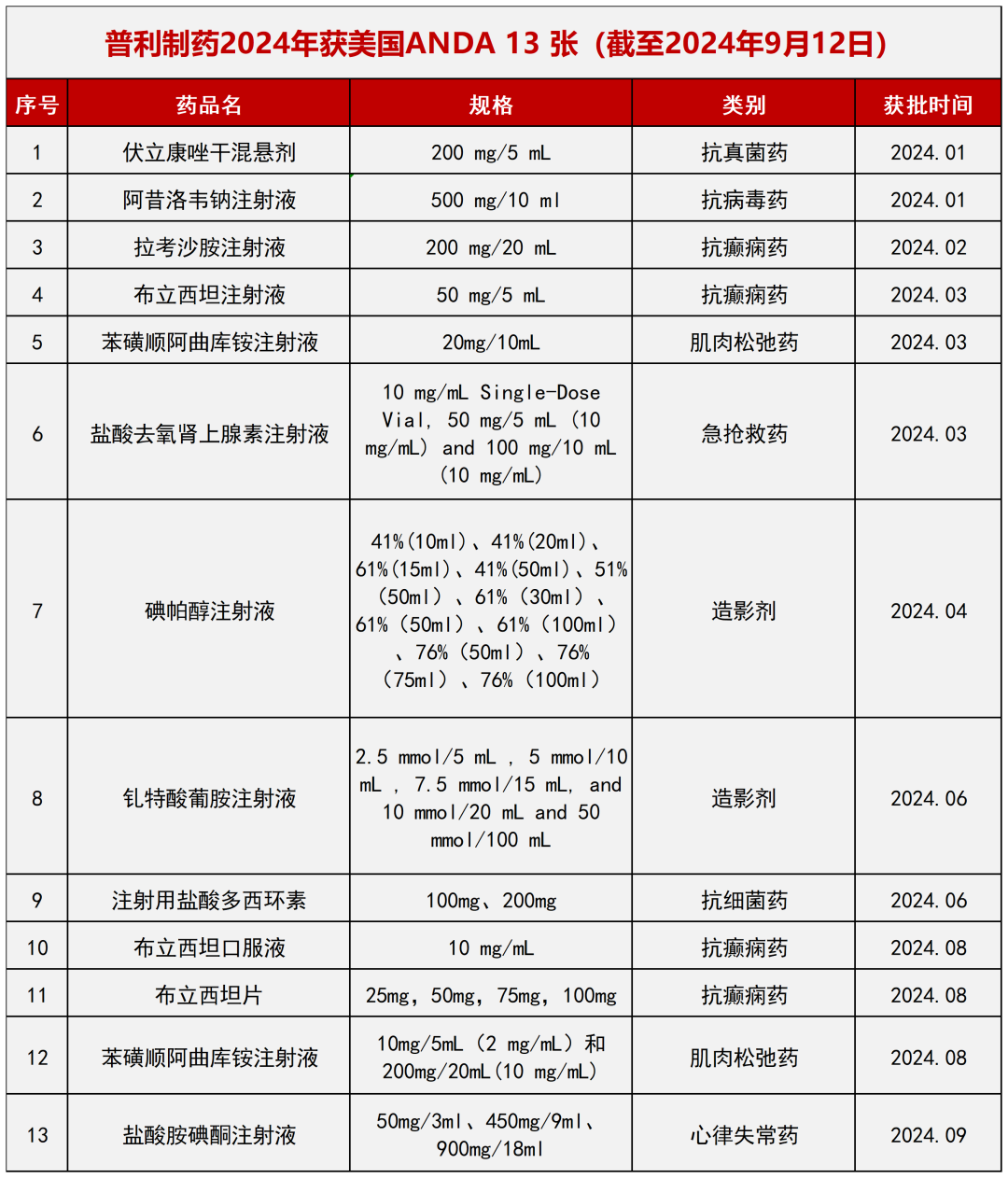
2024年第十三张美国ANDA
盐酸胺碘酮注射液的FDA批件,是普利制药今年的第十三张ANDA。
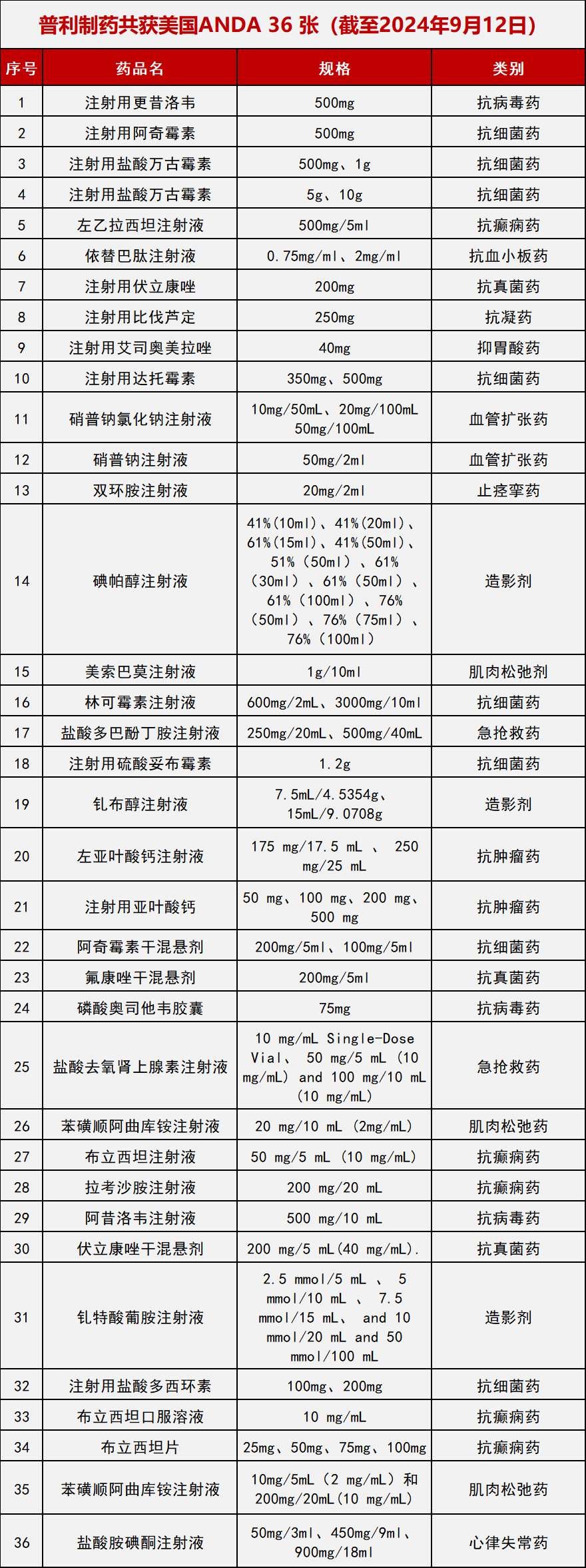
近几年,普利制药国际批文数量快速增长,目前已经有43款药物获得国际批件160多个。2023年普利制药美国ANDA批文数量位居全国第二。至今普利制药共获得美国ANDA 36张,其中2024年就获得美国ANDA 13张,目前还有7张ANDA在审批中,2024年有望成为全国ANDA批文数第一。

中国医药企业管理协会认证2023年普利制药美国批文数量全国第二
美国是全球第一大市场
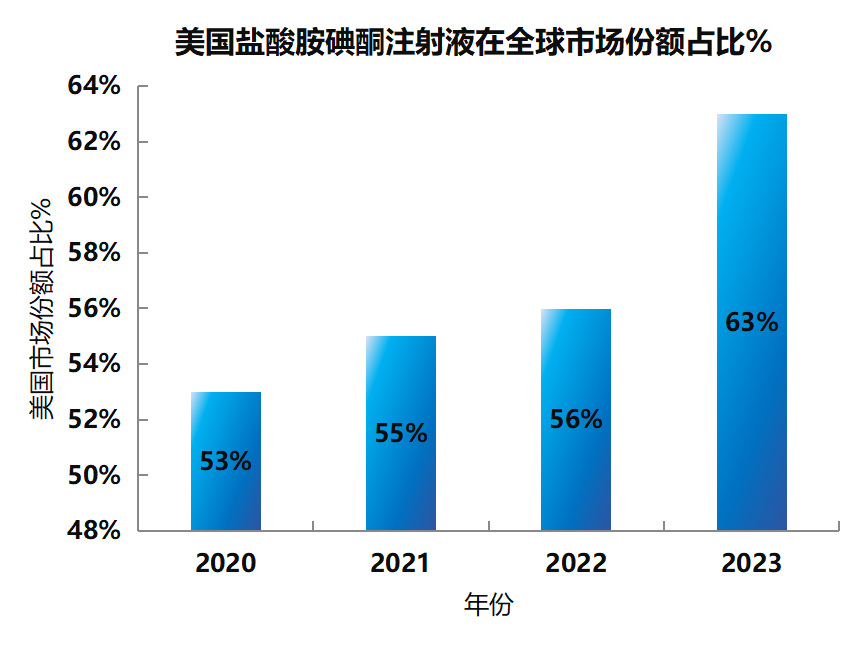
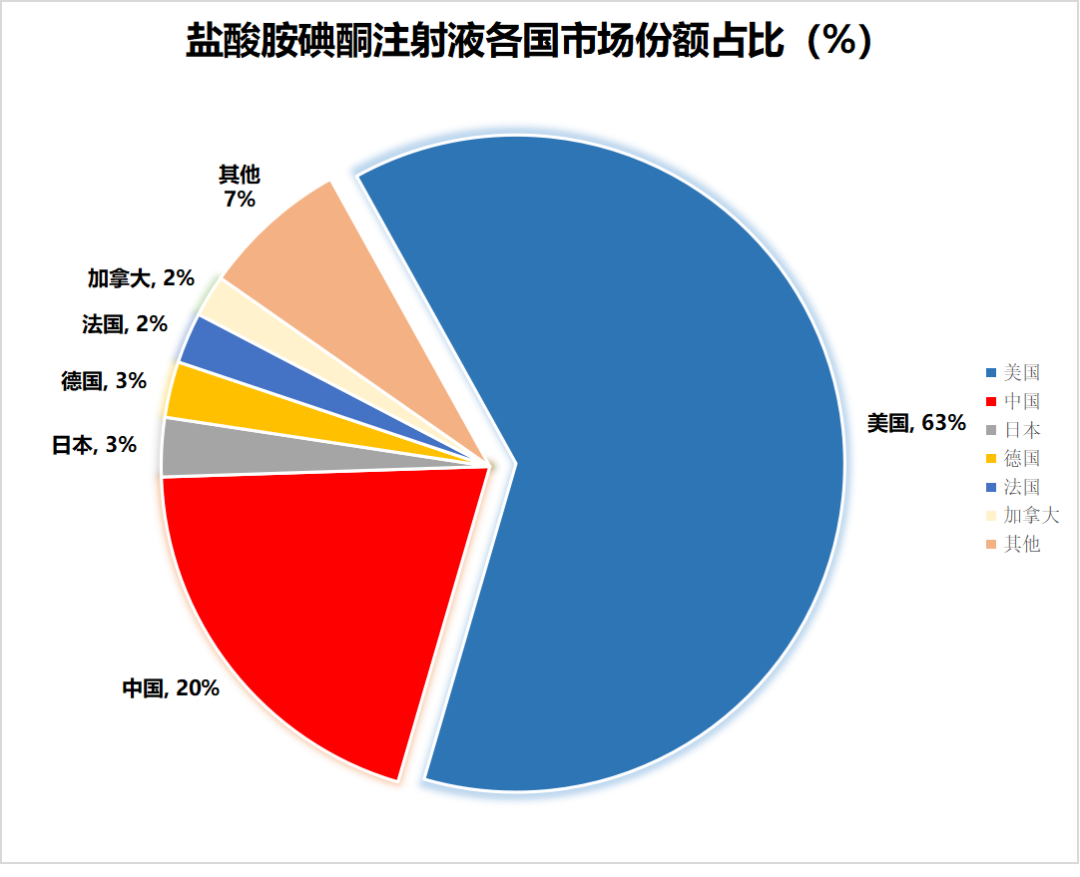
根据IMS的数据显示,2023年全球盐酸胺碘酮注射液的销售额约为8.68亿元人民币,其中美国市场占据了63%的份额,为全球最大的市场。
在过去的三年中,美国盐酸胺碘酮注射液全球市场份额持续增长。具体而言,2020年美国市场占据了全球53%的份额;2021年这一比例上升至55%;2022年进一步增至56%;而到了2023年,美国市场在全球的份额已达到63%。美国市场一直是盐酸胺碘酮注射液全球最大的市场。
原料制剂一体化品种
盐酸胺碘酮注射液是普利制药开发的原料制剂一体化品种。盐酸胺碘酮原料为中美欧申报,中国(登记号:Y20210001090)和欧洲(CEP证书编号:R0-CEP 2021-481-Rev 00)已经获批;美国盐酸胺碘酮原料与制剂关联评审(DMF号:036163),同时获得批准。
作为原料制剂一体化品种,普利制药的盐酸胺碘酮注射液不会受制于原料药市场,可稳定保障临床供应。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。


















