1、为什么要做双抗ADC
肿瘤相关抗原(tumor associated antigen, TAA)是一类在肿瘤细胞上特异性高表达的重要成药靶点。已有诸多靶向TAA的单抗药物上市,早在1998年获批的曲妥珠单抗(商品名赫赛汀,Herceptin)便是其中一例,通过靶向肿瘤细胞表面抗原Her2,阻断肿瘤细胞生长,起到治疗肿瘤的作用,成为乳腺癌和胃癌的一线治疗方案。然而,单抗药物作用机制有限且易产生耐药性,进而影响药物的治疗效果。
近些年,随着连接子(linker)和毒素分子(payload)技术的快速发展,基于TAA靶点的抗体偶联药物(antibody drug conjugates, ADC)取得了显著进步,到目前为止已经有针对11个TAA靶点的14款ADC药物获批上市。
ADC药物的作用机制是通过具有高内吞活性的抗体靶向识别,将毒素分子带入肿瘤细胞内,再利用毒素分子特异性杀伤肿瘤细胞。同时ADC药物一般采用可裂解的连接子,在胞内更高效的释放毒的同时也可以通过旁观者效性(bystander effect)实现对临近肿瘤细胞的杀伤,增强ADC药物的治疗效果。针对Her2已经有三款ADC药物获得FDA批准,分别是罗氏的Kadcyla,荣昌生物的爱地希和第一三共的Enhertu。
与单抗药物不同,双特异性抗体(双抗)可以同时识别一个靶点的两个表位或是两个不同的靶点,进而通过多种不同的分子机制产生更好的疗效。目前市面上共有3款获批双抗药物,还有超过100个产品处于临床开发阶段。
近些年针对TAA靶点的双特异抗体也取得了很大的进展。例如强生的Rybrevant是一款靶向EGFR和cMET的双抗产品,通过EGFR和cMET的快速内吞同时抑制这两条重要的肿瘤细胞生长信号通路,凭借其在临床一期的优异表现快速获得FDA批准上市,用于治疗具有特定耐药突变的非小细胞肺癌患者。
结合了双抗和ADC优势的双抗ADC药物,是一个更为崭新的概念。
一方面通过双抗更加特异性地靶向肿瘤细胞,增加药物的安全性;
另一方面通过交联作用促进两个靶点的协同内吞,在提高毒素进入肿瘤细胞效率的同时,进一步通过减少受体蛋白在细胞膜上的表达量来抑制肿瘤细胞生长信号,达到更好的治疗效果(图1)。
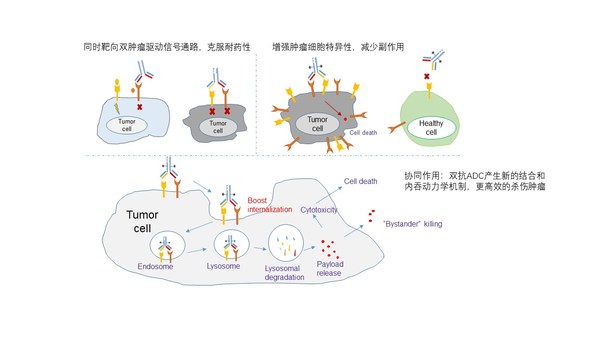
图1. 双抗ADC的作用机制及其优势
具有多重优势的双抗ADC无疑将成为未来创新药研发的新热点。目前这个方向的研究尚处于早期,仅有Merck的EGFR x MUC1双抗ADC(M1231)刚刚进入临床,临床前的在研产品也很少。
百奥赛图认为主要原因有两方面:
首先是能够用于双抗构建的抗体骨架分子较少,且靶点非常集中,仅在Her2, Her3, EGFR, MUC1等几个靶点上有好的可选抗体分子,缺少足够的“骨架”来快速搭建稳定表达的双抗ADC分子;
其次,目前针对这些分子的抗体大都是通过阻断活性筛选获得的,其内吞活性是否满足需求,能否作为ADC药物的最佳候选抗体分子也尚未可知。
百奥赛图基于共用轻链全人抗体小鼠RenLite的双抗ADC平台和“千鼠万抗”计划,针对以上两个问题开展了大量的工作,产生了针对众多靶点的、丰富且适合用于双抗ADC药物开发需求的抗体分子库,以规模化开发双抗ADC药物分子。
2、基于RenLite平台的双抗ADC药物研发
RenLite小鼠由百奥赛图利用自主研发的大片段染色体工程技术SUPCE(size unlimited precise chromosome engineering)开发的全人抗体小鼠,其中鼠的重链可变区已经被人的重链可变区进行了完整的原位替换,鼠的κ轻链可变区原位替换为人的共同固定轻链(图2A)。利用RenLite小鼠产生的全人抗体具有共同的轻链,从而可以有效解决双抗开发过程中的重链和轻链错配的问题,提高组装正确率。
我们的研究结果显示,固定轻链并不影响抗体在小鼠体内完成亲和力成熟,RenLite小鼠同野生型小鼠一样,能够产生表位丰富且亲和力强的抗体。结合KIH(knobs-into-holes)技术连接两个母本单抗的重链,可组装成结构稳定具有单抗结构的双抗分子(图2B),保障了后续ADC药物偶联的方便性和成功率。由此可见,高质量的母本单抗元件、简易的双抗组装方法以及单抗结构的双抗分子,满足了规模化开发双抗ADC药物分子的需要。
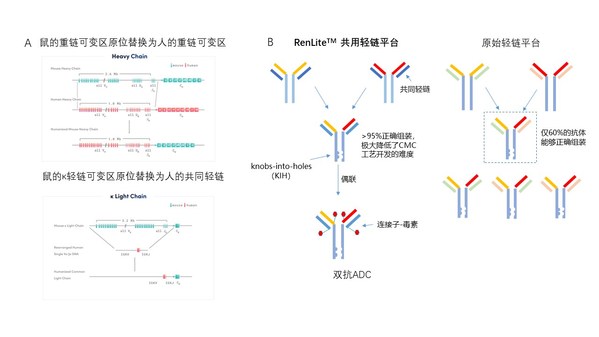
图2. 基于RenLite平台高通量地产出双抗ADC
百奥赛图于2020年3月发起千鼠万抗计划,对1000多个潜在可成药靶点进行规模化的抗体开发。这其中有200多个TAA靶点,有潜力生成大量的双抗组合,理论上可达20000种。为了使母本单抗更适用于后续双抗ADC的开发,除了常规的靶点亲和力筛选外,更增加了对抗体内吞能力的评估。大量经过各种筛选验证的ready-to-use的母本共用轻链单抗骨架,使得双抗的组装更加方便和快速。
百奥赛图已建立起上百种人肿瘤细胞系和PDX的抗原表达数据库,以及大量CDX/PDX肿瘤体内药效模型用于双抗ADC的药效及安全性评估。此外,我们还建立了自发肿瘤大动物转化医学平台,对通过小鼠体内药效筛选到的PCC分子进一步验证药效和安全性,从而缩小临床前和临床试验之间的距离,以提高临床转化成功率,让我们在做创新靶点药物研发的同时,尽可能降低临床试验的风险(图3)。
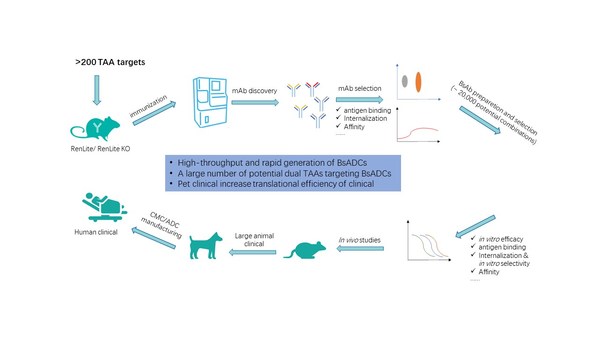
图3. 百奥赛图双抗ADC药物开发全流程
以百奥赛图自研的双抗ADC产品YH012(Her2 x Trop2 ADC)为例:其双抗骨架比对应母本单抗具有更强的内吞(共表达的NCI-N87细胞系),表现出靶点协同性;而在Trop2高表达、Her2低表达细胞系(NCI-H292),双抗内吞低于Trop2母本单抗,体现出双抗选择性(图4)。
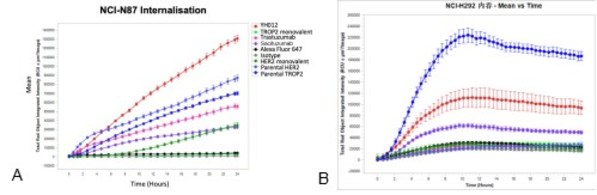
图4. Her2 x Trop2双抗骨架的内吞活性。
Her2 x Trop2双抗骨架具有良好的纯度和偶联性质,半胱氨酸方法偶联后DAR值近于4,具有良好的DAR分布(图5)。
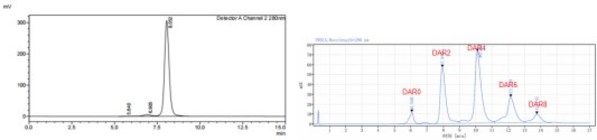
图5. Her2 x Trop2双抗的纯度(SEC-HPLC)和偶联后DAR分布(HIC-HPLC)
在加速热稳定和低pH条件下,Her2 x Trop2双抗骨架都显示出良好的抗体稳定性和理化性质(图6)。
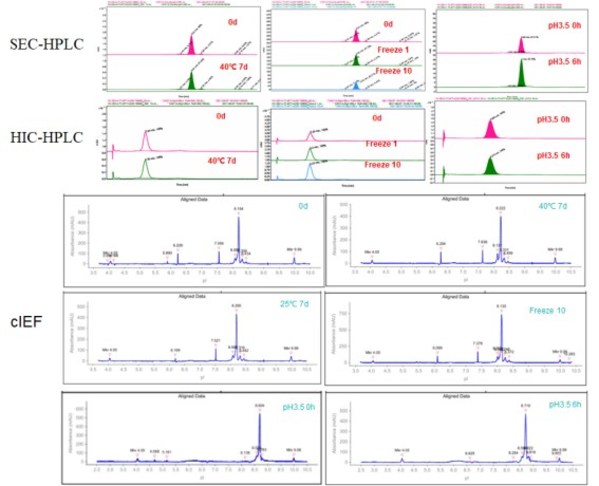
图6. Her2-Trop2双抗稳定性分析
在体外人肿瘤细胞杀伤试验中,药物偶联Her2 x Trop2后的双抗ADC YH012显示强杀伤,且和单价抗体相比具有显著差异;同时,YH012的杀伤同样具有选择性(图7)。
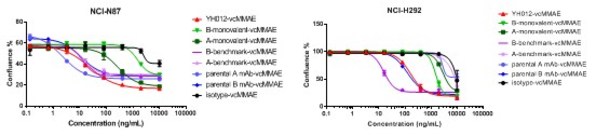
图7. YH012体外杀伤
在人肺腺癌细胞NCI-H1975(Her2,Trop2共表达)的CDX小鼠药效模型中,YH012相比阳性药ADC(benchmark)、母本单抗ADC均体现出更强和持续的抗肿瘤作用(图8)。
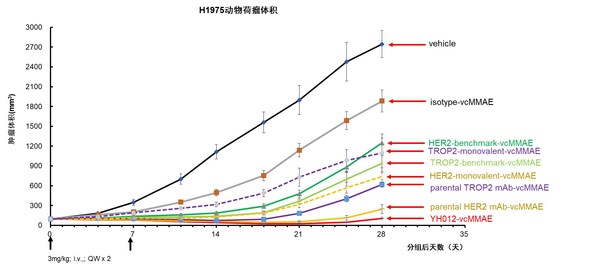
图8. YH012在NCI-H1975模型药效结果
运用公司大动物转化医学平台,我们进一步验证了YH012在自发肿瘤大动物体内的药效和安全性。在一条乳腺癌肺转移的犬中,低剂量(3mg/kg, Q2W)治疗不能抑制肿瘤生长,而高剂量(6mg/kg, Q2W)给药后,可以看到肿瘤持续缩小(图9)。大动物转化医学研究验证了YH012的有效性、剂量相关性和安全性。
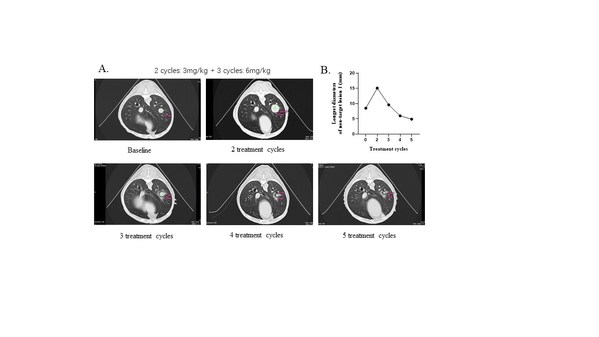
图9. YH012在大动物自发肿瘤模型中的响应
充足的可选TAA靶点,高质量的适用于双抗ADC药物形式的双抗骨架,完善的循证体内药效评估和大动物转化医学能力,使得我们能够快速获得大量优质的双抗ADC PCC分子。我们期待着与全球合作伙伴,深挖创新靶点和分子,共同加速推进双抗ADC药物的开发,早日造福病患。
文章投诉热线:156 0057 2229 投诉邮箱:29132 36@qq.com



