这一突破性的批准是基于AVA-PED-301研究的结果,这是一项全球性、随机、3期临床试验,旨在评估阿伐曲泊帕(Avatrombopag)在治疗儿童ITP患者中的疗效、安全性和药代动力学。近期,该项研究结果发表于《柳叶刀-血液学》。

AVA-PED-301是一项全球多中心、随机、双盲、安慰剂对照、平行分组的IIIb期研究。研究纳入年龄≥1岁至<18岁、确诊原发性ITP至少6个月且对既往治疗反应不足的患儿。
研究的核心阶段为12周双盲治疗期。主要终点为持续血小板应答,定义为在12周治疗期的最后8周内,至少有6周的血小板计数≥50×10⁹/L,且期间未接受挽救治疗。替代主要终点为血小板应答,定义为在12周治疗期内,至少连续两次血小板计数≥50×10⁹/L,且未接受挽救治疗。
在2021年3月2日至2023年8月2日期间,研究共筛查83例患儿,最终75例被随机分组:阿伐曲泊帕(Avatrombopag)组54例,安慰剂组21例。
主要终点:阿伐曲泊帕组中有15例患者(28%)达到持续血小板应答,而安慰剂组为0例(0%)。组间应答率差异为28%(95% CI 16-40;P=0.0077)。
替代主要终点:阿伐曲泊帕组中有44例患者(81%)达到血小板应答,安慰剂组同样为0例(0%)。组间应答率差异为81%(95% CI 71-92;P<0.0001)。
安全性方面,该研究表明其在儿科人群中显示出良好的安全性特征。
该研究表明,对于病程≥6个月的持续性或慢性原发性ITP儿童与青少年患者,阿伐曲泊帕(Avatrombopag)是一种有效且安全的口服治疗选择。其疗效显著优于安慰剂,并且在儿科人群中显示出良好的安全性。
根据统计数据,在儿童中,ITP的发生率约为每年每10万名儿童中有5人患病。大约25%的新诊断ITP患儿会发展为慢性ITP,这使得长期治疗成为一项重要的医疗挑战。此次获批,为儿童ITP的临床治疗提供了全新、高效和安全的治疗选择。
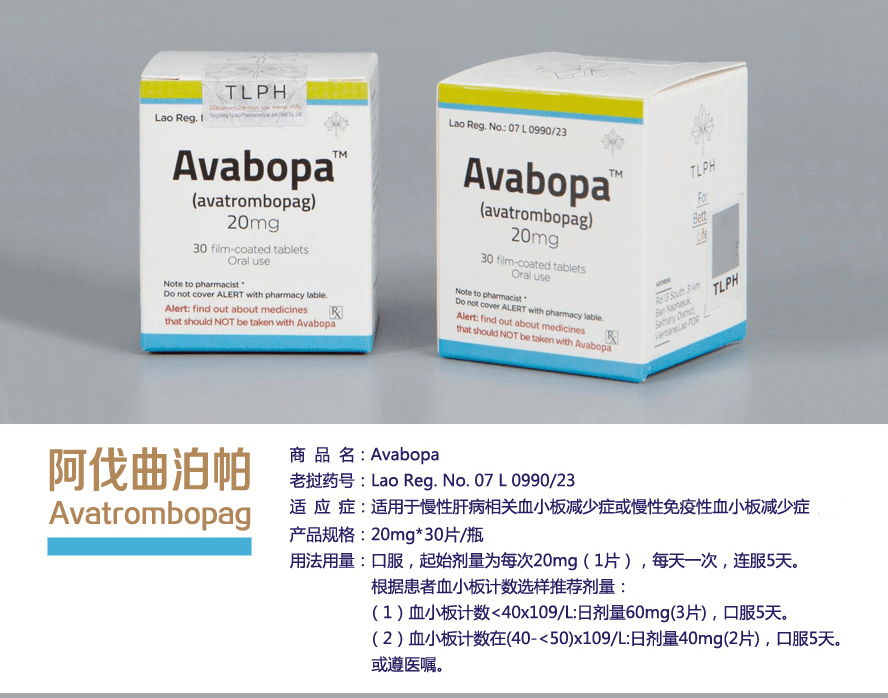
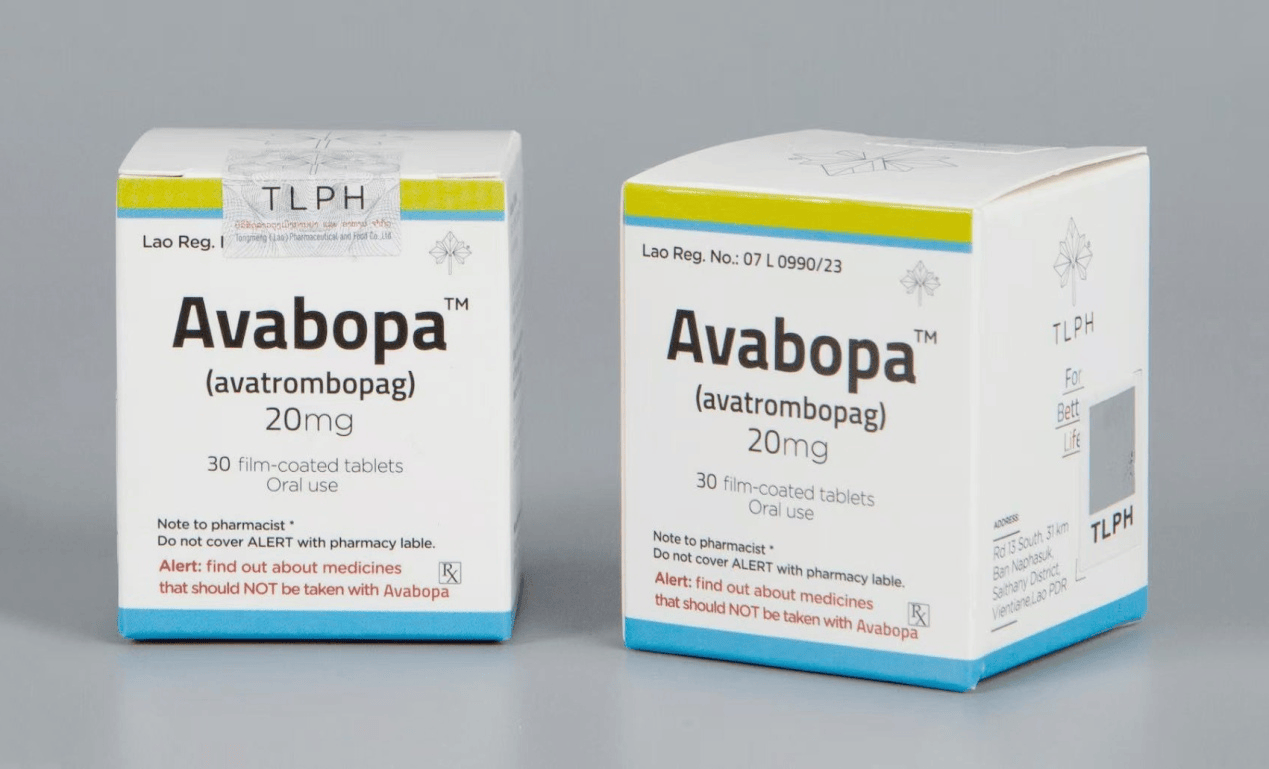
东盟制药(TLPH)生产的阿伐曲波帕(Avatrombopag)于2023年7月获老挝卫生部食品药品司(FDD)批准上市,一直以来受到广泛欢迎与赞誉。阿伐曲波帕最早获批用于治疗需要选择性诊断程序或程序的慢性肝病(CLD)相关性血小板减少症和免疫性血小板减少症(ITP);此次获批,使其适应患者人群更为广泛。
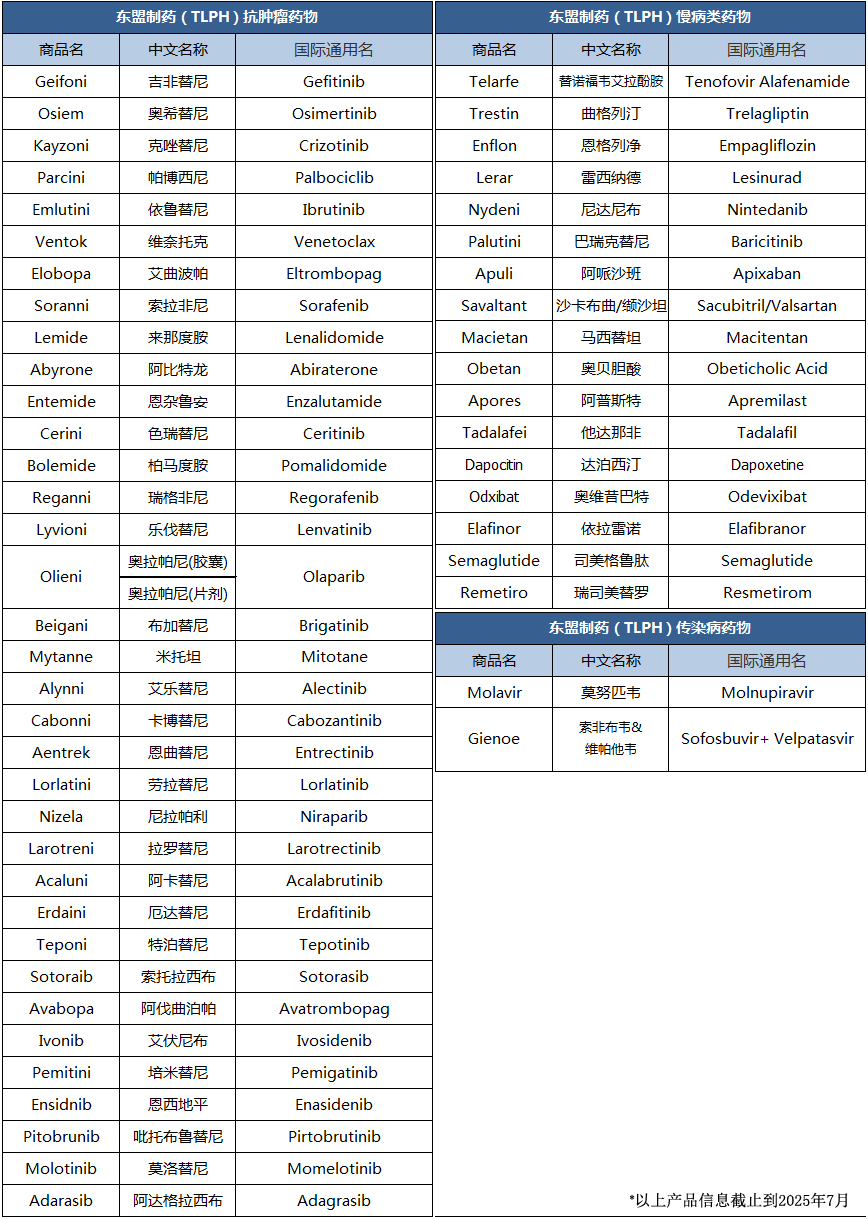

东盟制药(TLPH)是老挝境内首家现代化仿制药生产企业。在老挝政府“优质老挝药”国家产业战略发展中,东盟制药一马当先,依托全球领先的医药科技资源,积极开发和生产一线治疗药物,目前已获批上市的药品超过50款,涉及肿瘤、慢性病、传染病、男性健康等多个领域,累计为“一带一路”各国数以万计的患者提供“安全、高效、经济可负担”的优质药物解决方案,成为“优质老挝药”的标志性药企!
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。





